20/05/2025
Den biofarmaceutiske industri repræsenterer en revolution inden for moderne medicin. I modsætning til traditionelle lægemidler, der typisk er små, kemisk syntetiserede molekyler, er biofarmaceutika store, komplekse molekyler som proteiner og antistoffer, der produceres ved hjælp af levende biologiske systemer. Denne tilgang har åbnet døren for behandling af sygdomme, som tidligere var uhelbredelige, lige fra kræft og autoimmune lidelser til sjældne genetiske sygdomme. Men hvordan fremstilles disse avancerede lægemidler? Processen er en fascinerende, men yderst kompliceret rejse, der kræver præcision, avanceret teknologi og streng kvalitetskontrol. Denne artikel vil guide dig gennem de centrale trin i biofarmaceutisk fremstilling, fra den indledende cellekultur til det færdige, rensede produkt, og give et indblik i fremtidens teknologier, der former industrien.
Hvad er Biofarmaceutika?
Før vi dykker ned i selve fremstillingsprocessen, er det vigtigt at forstå, hvad der adskiller biofarmaceutika fra konventionelle lægemidler. Hvor traditionelle piller som aspirin eller paracetamol er kemisk simple og kan fremstilles gennem forudsigelige kemiske reaktioner, er biofarmaceutika typisk proteiner, der er produceret af levende celler. Disse celler – ofte pattedyrceller, bakterier eller gær – er blevet genetisk modificeret til at fungere som små "fabrikker", der producerer et specifikt terapeutisk protein.
Eksempler på biofarmaceutiske produkter inkluderer:
- Monoklonale antistoffer (mAbs): Bruges i vid udstrækning til at behandle kræft og autoimmune sygdomme ved at målrette specifikke celler eller proteiner i kroppen.
- Vacciner: Moderne vacciner, såsom mRNA-vacciner, bruger biologiske processer til at instruere kroppen i at opbygge immunitet.
- Rekombinante proteiner: Inkluderer hormoner som insulin til diabetesbehandling og vækstfaktorer til behandling af forskellige lidelser.
- Celle- og genterapier: Banebrydende behandlinger, der involverer modificering af patientens egne celler eller gener for at bekæmpe sygdom.
På grund af deres biologiske oprindelse og komplekse struktur er fremstillingen af disse lægemidler langt mere følsom og krævende end traditionel farmaceutisk produktion.
Fremstillingsprocessen: En Rejse i To Faser
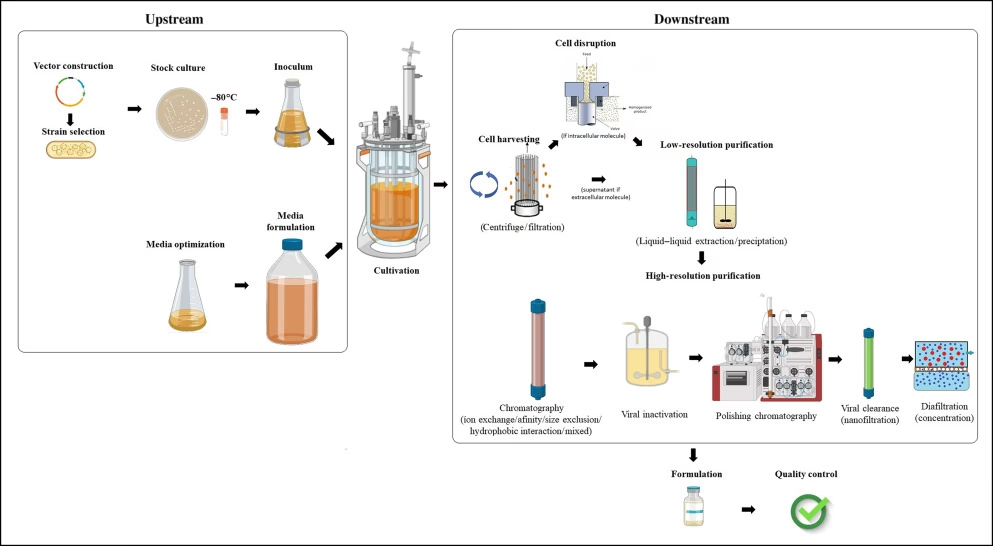
Den biofarmaceutiske fremstillingsproces kan generelt opdeles i to hovedfaser: Opstrømsprocessering (Upstream Processing) og Nedstrømsprocessering (Downstream Processing). Opstrømsfasen fokuserer på at dyrke cellerne og få dem til at producere det ønskede protein, mens nedstrømsfasen handler om at isolere og rense dette protein fra den komplekse blanding, det blev produceret i.
Fase 1: Opstrømsprocessering – Celledyrkning
Alt starter med cellerne. En lille mængde celler fra en omhyggeligt vedligeholdt cellebank (Master Cell Bank) tages ud og opformeres gradvist. Denne proces kaldes ekspansion.

Cellekultur og Fermentering
Cellerne overføres til større og større beholdere, indtil de til sidst ender i en stor bioreaktor. En bioreaktor er en avanceret, steril tank, der skaber det perfekte miljø for cellerne at vokse og producere protein i. Her kontrolleres kritiske parametre som temperatur, pH-værdi, iltindhold og næringsstoftilførsel med ekstrem præcision. Målet er at maksimere antallet af levedygtige celler og dermed udbyttet af det terapeutiske protein. Denne del af processen, kendt som cellekultur (for pattedyrceller) eller fermentering (for mikrober), kan vare fra et par dage til flere uger. Enhver lille afvigelse i disse parametre kan drastisk påvirke produktkvaliteten og udbyttet.
Fase 2: Nedstrømsprocessering – Høst og Rensning
Når opstrømsprocessen er afsluttet, indeholder bioreaktoren en kompleks "suppe" bestående af celler, det ønskede protein, restmedier, og en række uønskede biprodukter og urenheder. Nedstrømsfasens opgave er at isolere det terapeutiske protein i en yderst ren form.
Høst og Klargøring
Det første skridt er at adskille produktet fra cellerne, der producerede det. Dette gøres typisk ved hjælp af centrifugering, hvor den høje rotationshastighed tvinger de tungere celler og cellerester til bunden, mens det væskeløselige protein forbliver i den øvre væskefase (supernatanten). Alternativt kan dybdefiltrering bruges til at fjerne cellerne.
Rensning med Kromatografi
Kernen i nedstrømsprocesseringen er kromatografi. Dette er en række yderst selektive rensningstrin, der adskiller det ønskede protein fra andre proteiner og urenheder baseret på dets unikke fysiske og kemiske egenskaber, såsom størrelse, ladning og bindingsaffinitet. Processen involverer at føre væsken gennem en kolonne fyldt med et specialiseret materiale (en resin). Forskellige typer kromatografi bruges i sekvens for gradvist at øge produktets renhed. Det er en omkostningstung og tidskrævende proces, men den er absolut nødvendig for at sikre produktets sikkerhed og effektivitet.
Filtrering og Koncentrering
Mellem og efter kromatografitrinene bruges ofte teknikker som Tangential Flow Filtration (TFF). TFF bruges både til at koncentrere produktet (øge dets koncentration ved at fjerne vand) og til at udskifte den buffer, produktet er opløst i, som forberedelse til næste trin eller den endelige formulering.

Fjernelse af Virus
Et kritisk sikkerhedstrin er fjernelse og inaktivering af potentielle vira. Da cellerne er biologiske, er der en teoretisk risiko for viruskontaminering. Derfor indbygges flere robuste trin i processen, såsom virusfiltrering (hvor filtre med meget små porer fjerner vira) og lav-pH-behandling, der inaktiverer vira, for at garantere produktets sikkerhed.
Moderne Teknologier og Fremtidens Produktion
Industrien udvikler sig konstant for at gøre produktionen mere effektiv, fleksibel og sikker. Flere nøgleteknologier driver denne udvikling.
Single-Use Teknologier
Traditionelt har biofarmaceutisk produktion anvendt store, genanvendelige tanke af rustfrit stål, der kræver omfattende rengøring og sterilisering mellem hver produktionsbatch. I dag vinder single-use systemer (engangssystemer) frem. Disse er præ-steriliserede poser og slangesystemer af plastik, der bruges til en enkelt batch og derefter kasseres. Fordelene inkluderer:
- Reduceret risiko for krydskontaminering: Da udstyret er nyt hver gang.
- Øget fleksibilitet: Det er hurtigere at skifte mellem produktion af forskellige produkter.
- Lavere startinvesteringer: Kræver ikke de samme store anlægsinvesteringer som stålbaserede systemer.
Kontinuerlig Fremstilling
I stedet for at producere i separate batches, arbejder man hen imod kontinuerlig fremstilling, hvor alle procestrin er integreret i en kontinuerlig strøm. Dette kan føre til højere produktivitet, mere ensartet produktkvalitet og mindre anlæg. Det er en stor teknisk udfordring at integrere alle enhedsoperationer, men potentialet er enormt.
Fremtiden: Automation og Kunstig Intelligens
Fremtiden for biofarmaceutisk fremstilling ligger i den sømløse integration af automation, dataanalyse og kunstig intelligens (AI). Ved at indsamle og analysere enorme mængder data fra produktionsprocessen i realtid kan AI-modeller forudsige og optimere procesparametre, identificere potentielle problemer, før de opstår, og sikre en mere robust og effektiv produktion. Dette skaber et agilt og forbundet økosystem, der kan levere lægemidler af høj kvalitet hurtigere og mere pålideligt til markedet.
Sammenligning: Traditionel vs. Biofarmaceutisk Fremstilling
| Egenskab | Traditionel (Små Molekyler) | Biofarmaceutisk (Store Molekyler) |
|---|---|---|
| Udgangsmateriale | Kemiske råmaterialer | Levende celler (pattedyr, mikrober) |
| Produktkompleksitet | Lav (veldefineret struktur) | Høj (kompleks 3D-struktur, heterogen) |
| Processens følsomhed | Moderat | Ekstremt høj (følsom over for små ændringer) |
| Produktionsomkostninger | Relativt lave | Meget høje |
| Regulatorisk kontrol | Streng | Ekstremt streng (processen definerer produktet) |
Ofte Stillede Spørgsmål (FAQ)
Hvad er den største forskel på et biofarmaceutisk lægemiddel og en almindelig pille?
Den største forskel ligger i deres oprindelse, størrelse og kompleksitet. En almindelig pille (et lille molekyle) er kemisk syntetiseret og har en simpel, veldefineret struktur. Et biofarmaceutisk lægemiddel (et stort molekyle) er produceret af levende celler og har en stor, kompleks tredimensionel struktur, der er afgørende for dets funktion.

Hvorfor er biofarmaceutisk fremstilling så kompliceret og dyr?
Processen er kompliceret, fordi den involverer levende organismer, som er yderst følsomme over for deres miljø. Den mindste ændring kan påvirke produktkvaliteten. Rensningsprocesserne er også meget avancerede og kræver dyrt udstyr og materialer for at opnå den nødvendige renhed. Den strenge regulatoriske kontrol bidrager også til omkostningerne.
Er single-use systemer dårlige for miljøet?
Det er en kompleks diskussion. Selvom single-use systemer genererer plastikaffald, kan de have en lavere samlet miljøpåvirkning end systemer i rustfrit stål, når man medregner det enorme forbrug af vand, energi og kemikalier, der kræves til rengøring og sterilisering af genanvendeligt udstyr.
Hvilken rolle vil AI spille for patienter i fremtiden?
Ved at optimere produktionsprocesserne kan AI bidrage til at gøre biofarmaceutika mere tilgængelige og potentielt billigere. En mere robust og effektiv produktion kan også føre til hurtigere udvikling og godkendelse af nye, livreddende lægemidler, hvilket direkte gavner patienterne.
Konklusion
Biofarmaceutisk fremstilling er en hjørnesten i moderne medicin, der muliggør produktionen af nogle af de mest innovative og effektive behandlinger på markedet. Processen er en sofistikeret balance mellem biologi, ingeniørvidenskab og streng kvalitetskontrol, der strækker sig fra dyrkning af celler i bioreaktorer til omhyggelig rensning gennem flere trin. Med fremkomsten af teknologier som single-use systemer, kontinuerlig fremstilling og kunstig intelligens står industrien over for en fremtid med endnu større effektivitet, fleksibilitet og potentiale til at levere livsændrende medicin til patienter verden over.
Hvis du vil læse andre artikler, der ligner Biofarmaceutisk Fremstilling: En Dybdegående Guide, kan du besøge kategorien Medicin.
